公司介绍
康方生物成立于2012年,是一家致力于研究、开发、生产及商业化全球病人可负担的创新抗体新药的生物制药公司。于2020年4月24日正式在香港联合交易所有限公司主板挂牌上市。
公司创设了独有的端对端康方全方位新药研发平台(ACE Platform),以Tetrabody双特异性抗体、ADC技术、mRNA技术和细胞治疗技术为核心。目前拥有50多个创新候选药物,19个在临床研究,13项关键III期临床试验进行中。已成功推出3个新药,包括安尼可®、开坦尼®和依沃西。其中依沃西创下中国创新药物对外权益许可最高交易金额纪录,肺癌领域三项适应症获得突破性治疗认定。2023年8月,依沃西首个新药上市许可申请获得受理,并获得优先审评资格。
公司发展过程
- 2012年3月 康方生物成立,成为中国新时代生物医药创新的先行者
- 2015年11月 康方生物CTLA-4以2亿美元对价授权予默克,成为中国第一家将自主研发生物药物授权给全球制药TOP5的公司,同月完成1.3亿元人民币A轮私募融资
- 2017年8月 完成3亿元人民币B轮私募融资
9月 AK104在澳洲启动I期临床试验治疗实体瘤,Penpulimab (AK105) (PD-1) 在澳洲启动I期临床实验
12月 我们在中国启动AK101 (IL-12/IL-23)的I期临床实验
- 2018年3月 康方生物获得美国FDA对penpulimab (AK105)治疗宫颈癌及实体瘤的IND批准
6月 康方生物同GE进行合作,建立华南地区第一家采用GE Healthcare FlexFactory™(通用电气医疗灵活工厂技术)的生物制剂生产车间
10月 完成2亿人民币C轮融资
11月 自主研发的全球首创用于肿瘤免疫治疗的抗PD-1/CTLA-4双特异性抗体新药AK104入选“2017年中国医药生物技术十大进展”
- 2019年6月 康方生物与中国生物制药合作,共同开发并实现penpulimab(AK105)的商业化
11月 康方生物完成近1.5亿美元D轮融资
- 2020年4月 康方生物在香港交易所挂牌上市(9926.HK)
- 2021年3月 康方中新广州知识城的生物制药基地——康方药业项目一期正式投产,这是康方生物第二个具备产业化生产能力的生产基地,标志着公司产业化生产能力再上新台阶。
- 2022年12月 康方生物以高达50亿美元交易总金额,授予Summit Therapeutics于美国、加拿大、欧洲和日本的开发和商业化依沃西的独家许可权。
- 2023年1月 公司首款自主创新研发的差异化PD-1单抗安尼可®,继霍奇金淋巴瘤之后第二个适应症获得国家药品监督管理局批准,用于联合化疗一线治疗局部晚期或转移性鳞状非小细胞肺癌。
公司股价变动
图片来源:yahoo财经
投资优势
- 技术平台竞争优势
ACE平台
康方生物专注于高效、突破性的研发创新,致力于开发国际领先的新药。他们自成立以来一直致力于内部开发能力,打造了全方位的药物研发平台——ACE平台。这个平台涵盖了药物研发的各个环节,从靶点验证到临床前研究,再到符合GMP要求的生产。ACE平台贯穿候选药物的全生命周期,降低了对外部服务的依赖,提高了研发效率,成功率,并降低了开发成本。他们专注于肿瘤、自身免疫、炎症、代谢疾病等领域,已开发出超过50个拥有完全自主知识产权的创新候选药物,其中19个已进入临床阶段,其生产流程均来自内部工艺开发平台。
Tetrabody技术
Tetrabody技术是康方生物自主研发的专有技术,用于设计和生产创新的四价双特异性抗体。该技术解决了双特异性抗体在表达水平、结构异质性和稳定性等方面的难题。基于这一技术,康方生物成功开发了6个领先的双特异性抗体药物,包括肿瘤双免疫检查点双抗开坦尼®(PD-1/CTLA-4双抗),PD-1/VEGF双特异抗体新药依沃西(AK112),以及TIGIT/TGF-β双靶点抗体融合蛋白新药AK130等,彰显了公司在双特异性抗体领域的创新和领先地位。
- 研发竞争优势
康方生物始终致力于建立达到国际严格生产规范(GMP)标准的优良生产设施体系。
该生产体系是根据NMPA、FDA和EMA 的要求进行设计和验证,用以支持从药物发现到工艺开发、GMP合规试点和商业生产的整个药物开发过程。同时我们对生产设施进行日常过程审核、全面年度审核,以评估对GMP和相关质量标准的遵守情况。
公司目前在中山、广州等地建设生产设施,总产能将超过160,000L,成为中国最大的智能化生物制药企业。
劣势分析
- 行业监管风险
国家药品监督管理局负责对全国药品市场进行监督管理,并实行生产许可制度,公司主要产品出口地也对药品实行严格的许可或者认证及监督管理制度。若公司未来不能持续满足我国以及进口国行业准入政策以及行业监管要求,或者公司出现违法、违规等情形,则可能受到我国以及 进口国相关部门的处罚,从而对公司的生产经营带来不利的影响。
- 研发投入高昂
生物医药产品的研发是复杂、漫长且成本高昂的过程,需要大量人才、资金、设备和数据支持。统计数据显示,一个创新药品从发现到上市平均需要10-15年,耗费20-30亿美元资金。然而,研发成功率很低,只有约10%的候选化合物能进入临床试验阶段,约1%最终能获得上市许可。
我国生物医药企业虽然加大了研发投入力度,但仍存在以下问题:研发投入总量不足,研发投入结构不合理,以及研发投入效益不明显。2020年,我国医药工业企业研发经费支出占营收比重仅为4.6%,低于欧美等国家水平。此外,研发投入结构不合理,创新药企业的申报数量远低于仿制药企业,CRO服务质量和效率仍有待提高。研发投入效益方面,仅有少数化学药物和生物医药产品获得上市许可,创新能力和质量水平仍需提高。
- 审批周期长久
生物医药产品的审批是一个复杂的过程,需要涉及多个部门、环节和标准,确保安全性、有效性和质量可控性。我国生物医药产品的审批工作虽然有所改善,但仍存在以下问题:审批周期不稳定,效率未能与申报量同步提高,导致审批周期波动大;审批标准不统一,我国产品想进入欧美等市场需进行额外试验或重新开展试验;审批机制不完善,需要建立统一的电子监管系统和加强知识产权保护。
风险提示
- 医药相关政策收紧风险:由于创新药板块受政策影响较大,若监管政策出现一定的调整,可能会导致板块 行情的波动。
- 创新药临床推进低于预期,产品及技术授权交易取消风险及技术迭代风险。
- 市场风险偏好变化的风险:创新药本身是高风险的行业,因此可能受到市场资金的风险偏好的影响,当市场 风险偏好下降时,可能会导致创新药板块估值受到影响。
- 临床试验失败的风险。
如何在uSMART进行交易:
进入uSMART SG APP------搜索关键词“09926",选择相关ETF------点击交易,选择”买/卖“-------解锁交易。
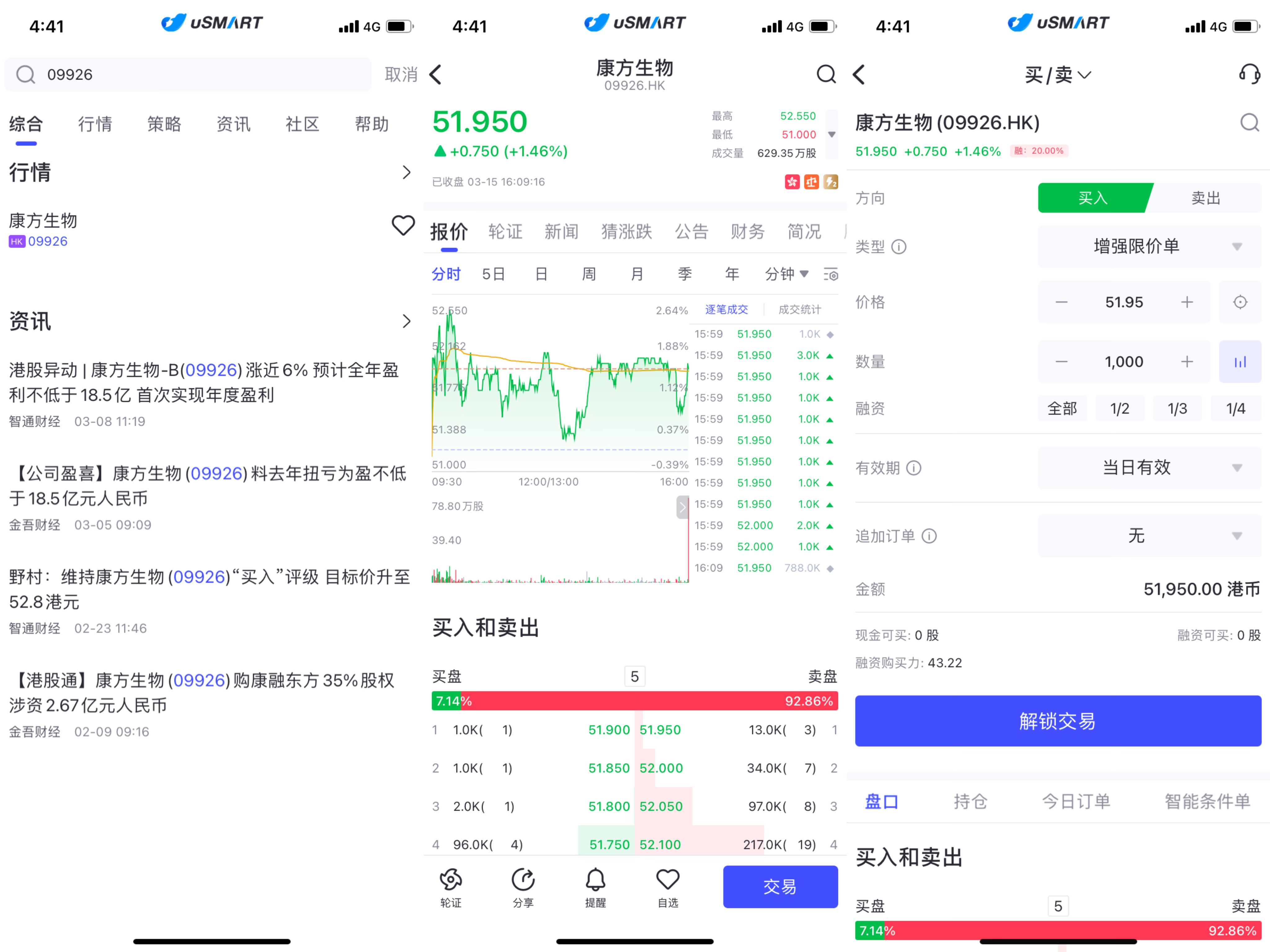 此图仅供说明之用
此图仅供说明之用
追踪我们
在 Twitter, Instagram, YouTube 和 TikTok 追踪我们,查阅更多实时财经市场资讯。
想和全球志同道合的人交流和发现投资的乐趣?加入uSMART投资社群并分享您的独特观点!立刻体验uSMART?点击下方图片下载uSMART app。
重要提示及免责声明
我们在撰写这篇文章时,基于我们的内部研究和可靠的公开信息来源。尽管我们在准备这篇文章时已经采取了所有合理的注意事项,但我们不保证本文中的信息准确或完整,并对事实错误或本文中的任何观点不承担责任。观点、预测和估计反映了我们在文章发布日期的评估,并可能发生变化。我们无义务通知您或任何人有关任何此类变化。您必须对本文中涉及的任何事项做出独立判断。我们及我们各自的董事、高管或员工将不对任何人因依赖本文中的任何陈述或遗漏而遭受的任何损失或损害承担责任。
这些证券的价值和收益可能会上升或下降。您的投资面临投资风险,包括收入和资本损失。过去的业绩数据以及本文中使用的任何预测或预测并不代表其未来表现。
此广告未经新加坡金融管理局审查。

 新加坡官网
新加坡官网 香港官网
香港官网 集团官网
集团官网 国际官网
国际官网